2-3 قلیائیت (Alkalinity)
قلیائیت به یون هایی از آب اطلاق می شود که برای خنثی سازی یون های هیدروژن، در واکنش شرکت می کنند. قلیائیت معیاری برای توانایی آب، جهت خنثی سازی اسیدها به حساب می آید. قلیائیت به آب مزه ای تلخ می دهد، لذا در آب شرب از اهمیت ویژه ای برخوردار است.
اصولاً در آبهای طبیعی، سه نوع آنیون، قلیائیت آب را بوجود می آورند که شامل: کربنات (CO32-)، بیکربنات (HCO3-) و هیدروکسید (OH-) می باشد. دیگر نمک های اسید ضعیف مثل برات ها، سیلیکات ها، فسفات ها و آمونیاک (NH3،HS-،H2PO4-،HPO4-2،H2BO3-،HSiO3-) نیز ممکن است به مقدار کم در آبها یافت شود.
بیشتر آبهای طبیعی، حاوی قلیائیت بیکربناتی هستند و pH آنها کمتر از 2/8 تا 4/8 می باشد.
ترکیباتی که بر قلیائیت آب اثر می گذارند، از طریق موارد ذیل ایجاد می گردند:
الف- تجزیه مواد معدنی موجود در خاک یا اتمسفر،
ب- تجزیه میکروبی مواد آلی،که باعث تولید موادی نظیر سولفید هیدروژن و آمونیاک می شوند،
ج- شوینده ها، کودهای شیمیایی و حشره کش ها، که باعث تولید موادی نظیر فسفات می شوند.
اندازه گیری قلیائیت به کمک تیتراسیون آب، با یک اسید و تعیین اکی والان هیدروژن صورت می پذیرد. قلیائیت بر حسب میلی گرم در لیتر CaCo3 بیان می شود.
1-2-3 انواع قلیائیت:
1. قلیائیت ساده (که به آن قلیائیت نسبت به فنل فتالئین می گویند).
2. قلیائیت کل (که به آن قلیائیت نسبت به متیل اورانژ می گویند).
2-2-3 محدودیت های ناشی از قلیائیت آب:
- یکی از اثرات منفی قلیائیت، طعم تلخی است که به آب می دهد.
- همچنین در آب قلیائی، می تواند واکنش هایی بین عامل قلیائیت و بعضی از کاتیون های محلول در آب رخ دهند و در اثر آن رسوب تولید می شود. رسوب حاصله از این واکنش ها می تواند باعث مسدود شدن لوله ها و دیگر تاسیسات شبکه آبرسانی شود.
- هرچه قلیائیت ساده کمتر، و قلیائیت کل بیشتر باشد، pH آب نیز کمتر خواهد بود. و هرچه قلیائیت ساده، بیشتر شود، pH آب نیز بیشتر می گردد. زیرا قلیائیت ساده معرف غلظت یون های هیدرواکسید و کربنات است که در pH های خیلی قلیایی، دارای غلظت قابل توجه هستند.
3-2-3 اهمیت قلیائیت در صنعت و تصفیه آب:
- در سیستم های صنعتی، اگر قلیائیت کل آب های مورد استفاده در دیگ های بخار، زیاد باشد، در داخل این دیگ ها، گاز CO2 تولید می شود و این گاز که وارد خطوط لوله بخار شده و باعث خوردگی می گردد. همچنین قلیائیت زیاد آب های دیگ بخار، به علت حضور غلظت زیاد OH-، باعث شکنندگی قلیایی خواهد شد. علاوه بر آن، قلیائیت زیاد در دیگ بخار، باعث حمل مواد (Carry Over) می شود.
- علاوه بر دیگ های بخار، در سیستم های خنک کننده نیز، قلیائیت کل آب باعث خورندگی و یا رسوبگذاری می شود.
معیارهای خوردگی آب
- مقدار قلیائیت آب در تصمیم گیری نسبت به انتخاب روش نرم سازی (حذف قسمتی از املاح محلول آن) آب نقش مهمی دارد. روش نرم سازی (بوسیله آهک و سود) پارامتری است که بسیار بستگی به قلیائیت دارد.
- در آبهای طبیعی، قلیائیت به عنوان عامل تامپونی در آب عمل می کنند و لذا هرچه قلیائیت آب بیشتر باشد، شدت تغییرات pH (در برابر افزایش اسید یا باز)، کمتر خواهد بود.
- در تصفیه فاضلاب، قلیائیت آب در فرایندهای تصفیه (از قبیل انعقاد و لخته سازی) کاربرد دارد و باید به مقدار کافی وجود داشته باشد، تا اینکه ترکیبات اسیدی حاصل از مواد لخته ساز یا منعقدکننده را خنثی سازد و همچنین تغییرات شدید pH آب را کنترل کند.
- قلیائیت به عنوان شاخصی برای ارزیابی ظرفیت تامپونی فاضلابها می باشد و در کنترل خورندگی آب و فاضلاب ها بکار می رود.
4-2-3 قلیائیت زدایی (Dealkalization)
معمولاً شرایط بهره برداری در صنعت نظیر دیگ های بخار و یا سیستم های خنک کننده، لازم می نماید که مقادیر سختی و قلیائیت آب کاهش داده شوند، ولی حذف دیگر املاح لازم نمی باشد.
کاهش سختی آب بوسیله زئولیت، باعث کاهش قلیائیت آب نمی شود. از سوی دیگر، نمک زدایی آب تاسیسات صنعتی نیز هزینه زیادی دارد. در چنین شرایطی فرایند قلیائیت دزایی بکار برده می شود.
قلیائیت دزایی عبارتند از: 1- روش زئولیت سدیم/ زئولیت هیدروژن (جریان تقسیم شده)، 2- روش زئولیت کلرید-آنیونی و 3- روش کاتیون گر ضعیف، 4- تزریق اسید.





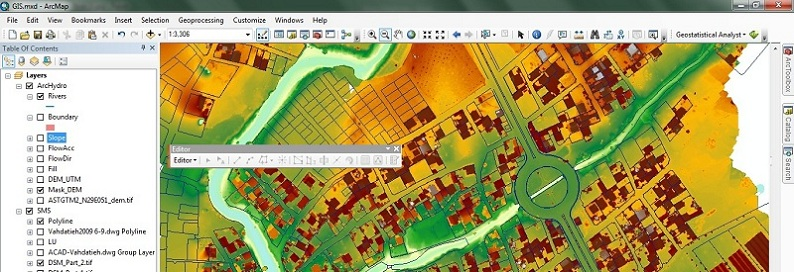
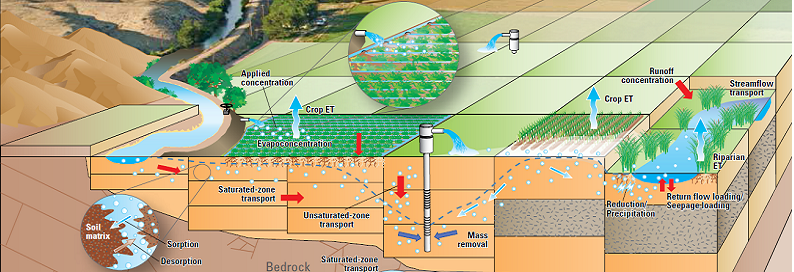




 در منابع آب
در منابع آب


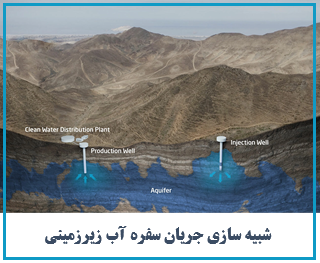


















نظرات (۰)