بخش هفتم کیفیت آب - عوامل بیماری زا در آب

5-4 آزمایش های میکروبی آب، از نظر کلی فرم ها:
در خصوص کلی فرم ها، آزمایش میکروبی آب، به سه روش انجام می گیرد، که عبارتند از:
1-5-4 روش تخمیر چند لوله ای:
این روش برای آزمایش نمونه های آب آشامیدنی، غیرآشامیدنی، نمونه های حاوی نمک یا آب شور، و یا نمونه های حاوی گل و لای، رسوبات و لجن کاربرد دارد. دقت این روش نسبتاً کم است، مگر اینکه تعداد نمونه های تهیه شده زیاد باشد.
از طریق روش آزمایش تخمیر چند لوله ای، میزان آلودگی آب تعیین می شود. با توجه به روشهای استاندارد (Standard Methods)، برای آزمایشات آب و فاضلاب تهیه شده بوسیله اداره بهداشت عمومی آمریکا، این تکنیک محتمل ترین تعداد یا تراکم باکتری های کلیفرم ها (Most Probable Number: MPN) را در 100 میلی لیتر از آب، ارائه نموده و یک روش غیر مستقیم بر اساس احتمالات آماری و مشاهده گاز در لوله های کشت شده می باشد. در این آزمایش می توان از چهار روش 5 لوله ای، 9 لوله ای، 10 لوله ای و 15 لوله ای استفاده نمود. روش¬های 9 و 10 لوله ای از بقیه متداول تر است.
برای محاسبه غلظت یا تراکم باکتری ها از روش بیان آماری، محتمل ترین تعداد یا بیشترین تعداد احتمالی(MPN) استفاده می شود. مقادیر MPN برای آزمایش های بسیار متنوعی که بر روی نمونه های گوناگون صورت گرفته محاسبه و در جداول مختلف درج گردیده است. این ارقام با در نظر گرفتن محدوده اطمینان 95 درصد برای هر MPN محاسبه شده است.
اگر حجم و غلظت نمونه های تهیه شده در یک آزمایش، همان مقادیری باشد که در جدول وجود دارند، می توان MPN مربوط به آن آزمایش را بر حسب MPN در 100 میلی لیتر، از جدول یافته و گزارش نمود، در غیر آن صورت می بایست با توجه به ضریب رقیق سازی، میزان MPN را از طریق جدول و یا از طریق رابطه توماس تعیین نمود.
در روش تخمیر لوله ای، تستهای سهگانه زیر وجود دارند:
1-1-5-4 تست احتمالی:
برای انجام این تست از لوله 9 تایی و یا 10 تایی که داخل هرکدام، یک لوله دورهام وجود دارد استفاده می شود. در هر لوله آزمایش 10 میلیلیتر از محیط کشت لوریل سولفات براث که حاوی 01/0 میلی گرم در لیتر برموکروزول ارغوانی می باشد، ریخته و سپس درب آنرا با پنبه بسته و استریل میشود. پس از استریزاسیون در کنار شعله الکلی و یا گاز آزمایشگاهی، به هر لوله 10 میلیلیتر از آب نمونهبرداری شده که حاوی تیوسولفات سدیم (1/0 میلیلیتر از محلول 10% تیوسولفات سدیم) می باشد، اضافه کرده و درب لولهها را با پنبه بسته و در انکوباتور 5/035 درجه سانتیگراد قرار داده میشود و پس از 224 ساعت، لوله را به آرامی تکان داده و داخل لوله دورهام مشاهده میشود. در صورت تولید گاز، پاسخ مثبت خواهد بود، در غیر اینصورت لولهها به مدت 24 ساعت دیگر در انکوباتور قرار داده میشوند تا بررسی لازم جهت تولید و یا عدم تولید گاز صورت گیرد.
وجود گاز پس از 48 ساعت دلیل بر مثبت بودن آزمایش است و اگر در هیچ یک گازی مشاهده نشد آزمایش احتمالی منفی است. نتایج این مرحله را بر حسب رقت و تعداد لوله های مثبت بصورت کد سه رقمی یادداشت می کنیم.
2-1-5-4 تست تأییدی:
این تست برای لولههایی است که در تست احتمالی، جواب مثبت تخمیری داشتند و در این مرحله، به محیط بریلیان گرینبراث (BGB) منتقل میشوند. این کار بوسیله یک لوپ فلزی 3 میلیمتری انجام میگیرد و یک قطره از محیط تخمیری به محیط کشت اضافه میگردد و لولهها در انکوباتور 5/035 درجه سانتیگراد، به مدت 348 ساعت قرار میگیرند. ظاهر شدن گاز در لولههای دورهام، نشانه مثبت بودن نمونهها است.
تشکیل گاز به هر میزان، در لوله های دورهام در هر زمان از 48 ساعت گرماگذاری، بیانگر پاسخ مثبت در این مرحله است. مقدار محتمل¬ترین تعداد کلیفرم در 100 میلی لیتر آب، از تعداد لوله های مثبت این مرحله، با استفاده از جدول یا فرمول تعیین یا محاسبه می گردد.
3-1-5-4 تست تکمیلی:
برای اطمینان از حضور باکتری های کلیفرم، آزمایش تکمیلی را بر روی حداقل 10 درصد لوله های مثبت مرحله تاییدی انجام می دهند. در این مرحله، از روش تایید مضاعف، یعنی استفاده مجدد از محیط کشت بریلیان گرینبراث (BGB-Broth) برای کل کلیفرم ها و ایسی براث (EC-Broth) برای کلیفرم های مدفوعی کمک گرفته می شود. باید توجه داشت که پاسخ مثبت به EC-Broth در دمای بالا (2/0-5/44 درجه سانتیگراد)، بیانگر نتیجه مثبت مرحله تکمیلی محسوب می گردد. پاسخ مثبت لوله های حاوی BGB broth، همراه با پاسخ منفی همان نمونه ها در EC-Broth، نشانگر حضور کلیفرم های غیر مدفوعی بوده و می بایست مجدداً در مرحله تکمیلی برای اثبات حضور کلیفرم ها مورد بررسی قرار گیرد. نتیجه مثبت EC-Broth، نشان دهنده مثبت بودن تست تکمیلی است.
2-5-4 روش صافی های غشایی:
از این روش، چون حجم زیادی از نمونه را می توان مورد آزمایش قرار داد و نتایج آن را سریع تر از روش تخمیر چند لوله ای بدست آورد، بیشتر استفاده می شود. این روش در آزمایش های آب آشامیدنی، آب های شور و انواع آب های طبیعی استفاده می شود. برای آبهای با کدورت بالا مانند فاضلاب و یا آب های فاقد کلی فرم، روش مناسبی نمی باشد، به ویژه به علت کدورت زیاد فاضلابی که مرحله تصفیه اولیه و کلرزنی را طی کرده، و همچنین برای فاضلاب حاوی فلزات و مواد آلی سمی هستند.
در این روش از دیسک های صافی به ضخامت 150 میکرومتر، که دارای سوراخ هایی به قطر 45/0 میکرون هستند، برای جداسازی باکتری ها از محیط آبی استفاده می شود.
در این آزمایش، ابتدا نمونه آب از صافی عبور داده می شود و تمام باکتری های موجود در نمونه از آن جدا شده و روی سطح صافی باقی می مانند. سپس صافی را روی صفحه جاذب اشباع شده با محیط کشت مغذی می گذارند، و به مدت 22 تا 24 ساعت در انکوباتور قرار داده می شود. ارگانیسم ها روی دیسک صافی، کلنی هایی تشکیل می دهند که می توان آن را زیر میکروسکوپ شمارش کرد. در محیط کشت اندو آگار، کلنی های تشکیل شده، دارای جلای فلزی طلایی رنگ براق هستند، که نشان دهنده وجود کلیفرم مدفوعی می باشد.
برای شمارش کلنی ها از واحد CFU) Colony Forming Units) یا واحد تشکیل کلنی، استفاده می شود.
3-5-4 آزمایش شمارش بشقابی هتروتروفیک:
اندازه گیری تراکم باکتری های هتروتروف هوازی و بی هوازی اختیاری در آب، به نام شمارش بشقابی هتروتروفیک نامیده می شود. باکتری های هتروتروف انرژی خود را از طریق اکسیداسیون مواد آلی بدست می آورند و مواد آلی به عنوان منبع کربن آنها محسوب می شوند. این روشی استاندارد است و یافتن تمام باکتری های موجود در یک نمونه آب، با یک روش منحصر صورت نمی گیرد.
6-4 شناسائی عوامل بیماریزای (پاتوژنها) احتمالی موجود در آب شرب
به منظور شناسائی عوامل بیماریزای احتمالی در شبکه مصرف آب شهر، نمونههائی را که تستهای احتمالی، تأییدی و تکمیلی آنها مثبت، و مقدار MPN آنها بیشتر از صفر باشد و اصطلاحاً آلوده گفته میشوند، کشت داده و سپس کلنیهای مربوطه اعم از پاتوژنها و غیره بر اساس روش های مربوطه (از قبیل کتاب میکروبیولوژی بنیادی)، مورد تشخیص و شناسائی قرار می دهند. این اقدامات شامل مراحل زیر میباشند:
1-6-4 فیلتراسیون:
در این روش در حدود 500 میلیلیتر آب را از یک فیلتر غشایی استریل (45/0 میکرون) عبور داده و سپس کاغذ غشایی را در روی محیط بلاد آگار گذاشته و در دمای 37 درجه سانتیگراد، به مدت 24 ساعت پرورش داده و کلنیهای رشد کرده شناسائی می گردند. برای پرورش باکتریهای سخت رشد، مجدداً نمونهها به مدت 24 تا 72 ساعت دیگر در دمای 37 درجه سانتیگراد در انکوباتور نگهداری میشوند. پس از رشد و ایزوله کردن باکتریهای سخت رشد، مجدداً نمونهها به محیطهای فاقد خون مانند برین هارت اینفوژن آگار (BHIA) برای انجام تست کاتالاز و اکسیداز و همچنین برای مشاهده کلنیها، بر روی محیطهای کشت EMB) Eosin Methylene Blue) و Macconkey برده شده و مجدداً انکوباسیون در حدود 2 تا 3 روز دیگر ادامه داده خواهد شد تا رشد و یا عدم رشد میکرواورگانیسمها در این محیطها مشخص گردد. در مرحله بعد تستهای بیوشیمیایی مانند استفاده از قندها جهت تخمیر یا اکسیداسیون، مصرف کربن، هیدرولیز اسکولین، تولید اندول، حرکت و غیره برای تشخیص نهایی بکار گرفته می شود.
2-6-4 رسوب:
در این روش از ظرف محتوی نمونه (500 میلیلیتر)، مقدار 50 میلیلیتر در سانتریفوژ با دور2500 در دقیقه به مدت 15 دقیقه قرار داده می شود و پس از رسوب کردن و جدا نمودن آن، 1 میلیلیتر سرم فیزیولوژی استریل بر روی آن ریخته و سپس آنرا بخوبی بهم میزنند. بعد از انجام این کار رسوب را در یک پلیت بلاد آگار پخش و توزیع نموده و آنرا به مدت 24 تا 48 ساعت در انکوباتور قرار داده تا رشد کلنیها صورت گیرد. پس از رشد باکتریها بر روی پلیت بلادآگار، عمل کلنیکانت انجام می گیرد و تعداد کلنیهای رشد کرده به ترتیب در 1، 50، 500 و 1000 میلیلیتر شمارش می گردند.
7-4 روش نمونهبرداری در بررسی های میکروبی
1-7-4 جهت تشخیص امکان آلودگی:
نمونهبرداری به منظور انجام آزمایشهای میکروبشناسی، بدلیل حساسیت بسیار زیادی که دارد، باید بدقت انجام گیرد، تا آب برداشت شده بیانگر شرایط واقعی جامعه آماری مورد نظر بوده و منابع آلودگی ثانویه وارد آن نشده باشد، همچنین شرایط اولیه خود را نیز حفظ نماید. به عبارت دیگر نمونهگیری باید اولاً، در ظروف استریل و در شرایط استریل صورت گیرد. ثانیاً، نگهداری و انتقال نمونهها باید بگونهای باشد که میکرواورگانیسمهای آب از زمان تهیه نمونهها تا زمان انجام آزمایشهای مربوطه زنده بمانند. برای رسیدن به چنین اهدافی، موارد زیر انجام گردید:
1- نمونهبرداری در ظروف 125 میلیلیتری شیشهای با درپوش سمبادهای صورت گیرد. بدین منظور، ابتدا این ظروف را کاملاً شسته و خشک کرده و سپس برای خنثی نمودن کلر موجود در آب نمونهگیری شده، مقدار 15/0 میلیلیتر از محلول تیوسولفات سدیم 10 درصد، به بطری اضافه میگردد.
2- ظروف شیشهای را در یک پوشش کاغذ آلومینیومی قرار داده و سپس آنها را جهت استریل کردن به مدت نیم ساعت در اتوکلاو 120 درجه سانتیگراد و فشار 1 کیلوگرم بر سانتیمترمربع قرار داده میشوند.
3- قبل از نمونهبرداری، ابتدا در حدود 2 دقیقه شیر را باز نموده تا جریان آب ایجاد شود. سپس محل خروجی آب از شیر را به وسیله چراغ الکلی در حدود 3 تا 5 دقیقه حرارت داده تا استریل گردد. سپس شیر را مجدداً به آرامی باز کرده و به مدت 2 دقیقه اجازه میدهیم تا آب از لوله با فشار کم خارج شود. در مرحله بعد، بطری را (به میزان 80 درصد حجم آن) پر از آب نموده و درپوش آنرا بلافاصله در جای خود قرار داده، و اطراف آن را به وسیله کاغذ آلومینیومی میپوشانیم.
4-بلافاصله بعد از نمونهبرداری، به منظور حفظ میکرواورگانیسمهای موجود در نمونهها، ظروف شیشهای را در یک کیف مخصوصی (Ice Bag) که مجهز به یخ جامد میباشد و دمای داخل آن در حدود 4 درجه سانتیگراد است، قرار داده و بلافاصله به آزمایشگاه مربوطه انتقال داده میشوند.
2-7-4 شناسائی عوامل بیماریزای:
جهت شناسائی عوامل بیماریزای موجود در شبکه شرب، نمونهبرداری در ظروف شیشهای 500 میلیلیتری با درپوش سمبادهای انجام می گیرد. قبل از نمونهبرداری، ظروف مربوطه را شسته، خشک نموده و سپس برای خنثی نمودن کلر موجود، مقدار 1 میلیلیتر از محلول تیوسولفات سدیم 10 درصد، به آب داخل ظروف نمونهبرداری اضافه می شود. متذکر می گردد که در این رابطه از هر محل نمونه برداری، دو ظرف نمونه تهیه می شود. یک نمونه جهت فیلتر سازی و دیگری جهت تهیه رسوب بوده است. بقیه مراحل نمونه برداری از قبیل استریل نمودن ظرف و شیر آب، نظیر بند فوق می باشد.

مدیر سایت: بهزاد سرهادی کارشناس ارشد مهندسی آب
شناسه تلگرام مدیر سایت: SubBasin@
نشانی ایمیل: behzadsarhadi@gmail.com
(سوالات تخصصی را در گروه تلگرام ارسال کنید)
_______________________________________________________
پروژه تخصصی در لینکدین




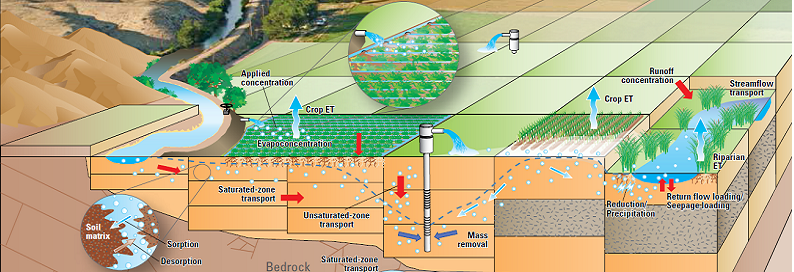



 در منابع آب
در منابع آب




















نظرات (۰)